研究内容紹介
「光合成細菌は光合成装置(色素ータンパク質超複合体)をどのように合成するか?」
河合 繁 JSPS外来研究員
紹介を始める前に、、、
久しぶり(約1年半)の「研究内容紹介シリーズ 」は、光合成に関する研究紹介です。 光合成って植物だよね?って思われた方、実は細菌の中にも光合成する子がいるのです! 執筆依頼から原稿完成までに半年近く掛かっており、編集担当者的には途中で御蔵入りも覚悟していた努力作なので、ぜひ詳しく読んでみてください。
今回の研究紹介は、生物が光合成をするための装置(タンパク質や色素)をどのような順序で作っていくのか?という問題に迫った研究内容についてです。
植物が昼間に光合成をして夜には呼吸をすることは、よく知られた話だと思います。一方で、『光合成細菌』という生物は多種多様であり、呼吸をしない種もありますが、今回は植物と同様に呼吸も光合成もできる細菌種を対象として、暗条件から明条件への移行期における光合成関連タンパク質が合成されていく様子を解析しました。
この研究は、超先鋭研究開発部門所属の4名によるもので、近年JAMSTECに導入された超高分解能質量分析計の使用をメインに据えプロテオーム解析を行ったものとしては当研究所初の論文となります。
発表された論文はこちら↓
Proteomic Time-Course Analysis of the Filamentous Anoxygenic Phototrophic Bacterium, Chloroflexus aurantiacus, during the Transition from Respiration to Phototrophy.
Kawai S, Shimamura S, Shimane Y, Tsukatani Y.
Microorganisms 2022, 10, 1288.
少し?長いので先に目次を記載します。
(クリックして頂くと各章に飛びます)
【そもそも光合成細菌とはなにか?】
【光合成細菌 C. aurantiacus の光合成装置】
【実験方法】
【研究結果1: C. aurantiacus の細胞増殖と色素含有量の変化】
【研究結果2: 経時的プロテオーム解析による光合成タンパク質の発現変動】
【研究結果3: 光合成色素の成分分析】
【考察: C. aurantiacus の光合成装置の形成プロセス】
【おわりに】
【そもそも光合成細菌とはなにか?】
光合成細菌は植物や藻類とは異なり、酸素を発生しない光合成『酸素非発生型光合成』を行います。
植物などの『酸素発生型光合成』をする生物は、光合成電子伝達を駆動させるための電子源として水を利用します。その過程で水が分解され、酸素が生じます。
(2H2O → 4H+ + O2 + 4e-)
一方で光合成細菌は、電子源として水ではなく、(種によりますが)硫化物や鉄や有機物などを利用するため、酸素が発生しないのです。
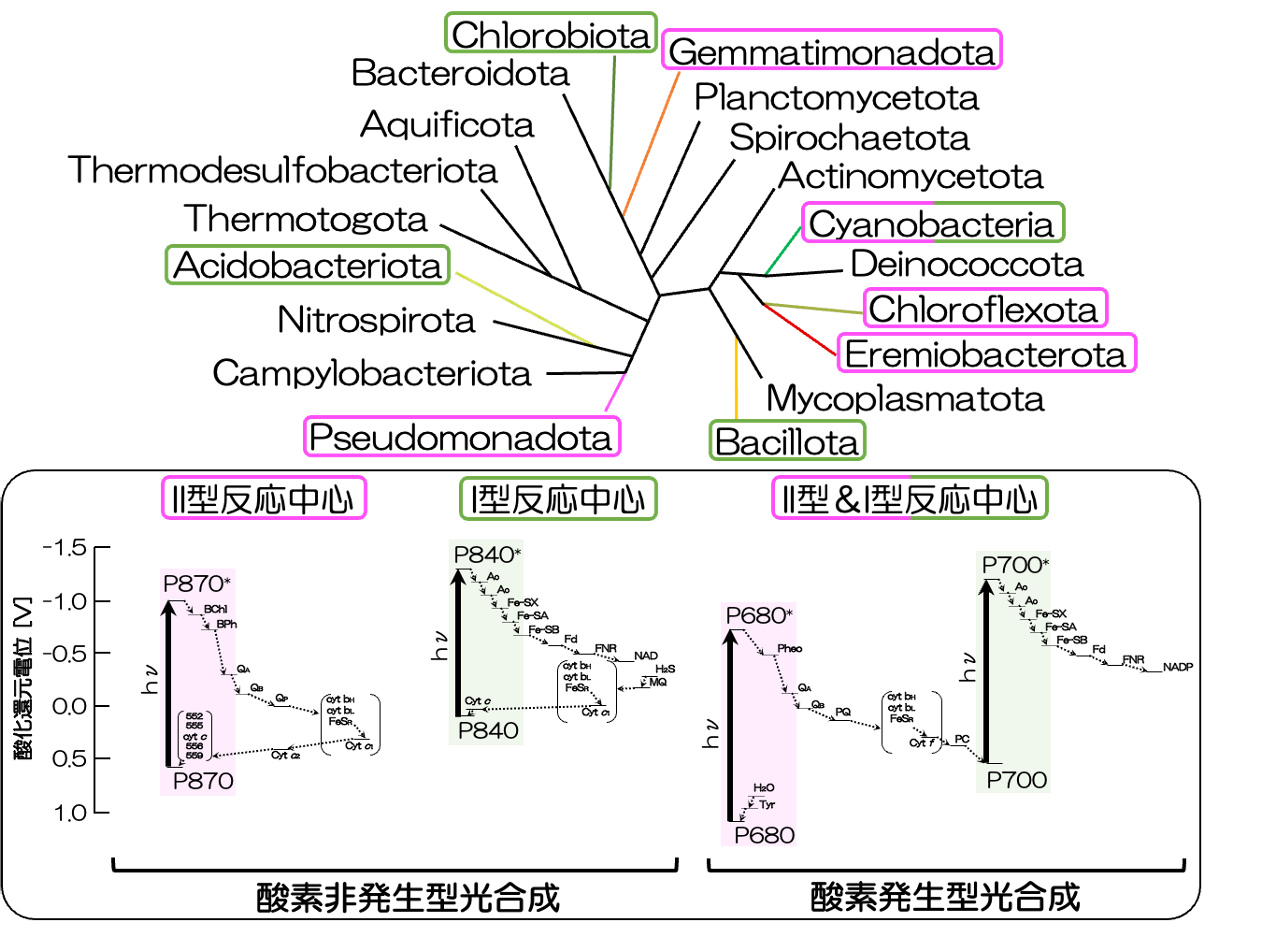
光合成細菌は、生物分類上、8つの門*注1に渡って発見されており、非常に多様性に富んでいます。少し専門的になりますが、8つの門は、Chloroflexota, Candidatus Eremiobacterota, Gemmatimonadota, Pseudomonadota, Acidobacteriota, Bacillota, Chlorobiota, そしてCyanobacteria です。これらの門ごとの光合成細菌グループは、それぞれに異なる光合成様式を持っていますが、大きく分類すると3つに大別できます(詳細は図1をご覧ください)。
-
図1 代表的な細菌門の無根系統樹と光合成細菌が持つ光合成電子伝達
光合成細菌が分類される8門は一部に集中するわけではなく、系統樹全体に広がっている。*参考文献[1] 光合成細菌はII型とI型いずれかの反応中心を有し、光合成電子伝達様式も異なる。*参考文献[2] なお、II型反応中心を持つ光合成細菌は光合成だけでなく他の代謝能力を併せ持つ通性タイプ、I型反応中心を持つ光合成細菌は光合成に頼った偏性タイプが多い。
今回の研究に使用したのは、Chloroflexota 門に分類される Chloroflexus aurantiacus という属種です。C. aurantiacus は世界各地の温泉に生息しており、現在見つかっている中では最も高温に適応した光合成細菌です。温泉は高温・貧栄養といった古地球環境と似た性質があるため、そこに生育する C. aurantiacus は光合成の進化を探る上で重要な微生物としてこれまで注目を集めてきました。
【光合成細菌 C. aurantiacus の光合成装置】
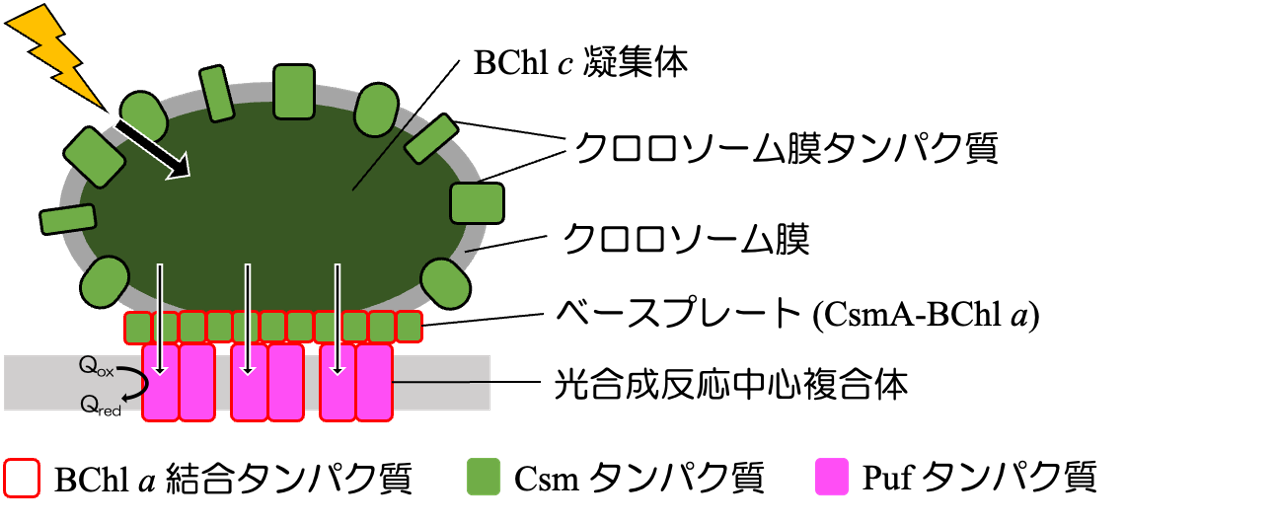
C. aurantiacus の特徴の1つとして、『クロロソーム』と呼ばれる、細胞膜の内側に接着する巨大なアンテナ器官を持つ点が挙げられます(図2)。なおクロロソームは、8つの門のうち、Chloroflexota, Chlorobiota, Acidobacterota に共通するアンテナ器官です。
クロロソームは、糖脂質とタンパク質の膜で囲われた嚢状であり、その内部にはバクテリオクロロフィル c(BChl c)という色素の会合体が大量に含まれています。この光捕集システムは、光合成生物の中でも最も光エネルギー伝達効率が高いと言われており、次世代の人工アンテナ装置開発に向けた応用研究も盛んに行われています。
-
図2 C. aurantiacus の光合成装置
光エネルギーを吸収したBChl c はクロロソーム基部のベースプレート等に結合したバクテリオクロロフィル a(BChl a)を介して光合成反応中心複合体にエネルギーを伝達する。矢印は光励起エネルギーの流れを示す。反応中心から放出される電子はキノンを還元し、電子伝達鎖を介したATP合成や生体構成物質の生合成などに利用される。
クロロソームのBChl c 色素で捉えられた光エネルギーは、『ベースプレート』という蛋白質構造体を経由して、『反応中心』という蛋白質複合体に伝わり、反応中心で電子伝達が始まることによって、生育に必要な化学エネルギーに変換されていくことになります。
ベースプレートや反応中心には、クロロソームにあるBChl c とは異なるBChl a という色素が結合しています(図2)。つまり C. aurantiacus は、2種類の異なる色素を生体内で合成するための酵素タンパク質をそれぞれ持っていて(一部は共通)、現在までに全ての合成酵素は同定されています。
このように、光合成反応を駆動するための装置には様々な光合成関連タンパク質が必要であることが分かっていますが、それらが細胞内でどのように順次発現し光合成装置を組み上げるのかについては、これまでよく分かっていませんでした。
【実験方法】
光合成装置の組み上げに必要な光合成関連タンパク質の発現機序は、光合成だけを行う生物ではなかなか解析ができません。そもそも生きるために光合成関連タンパク質を常に発現しているからです。
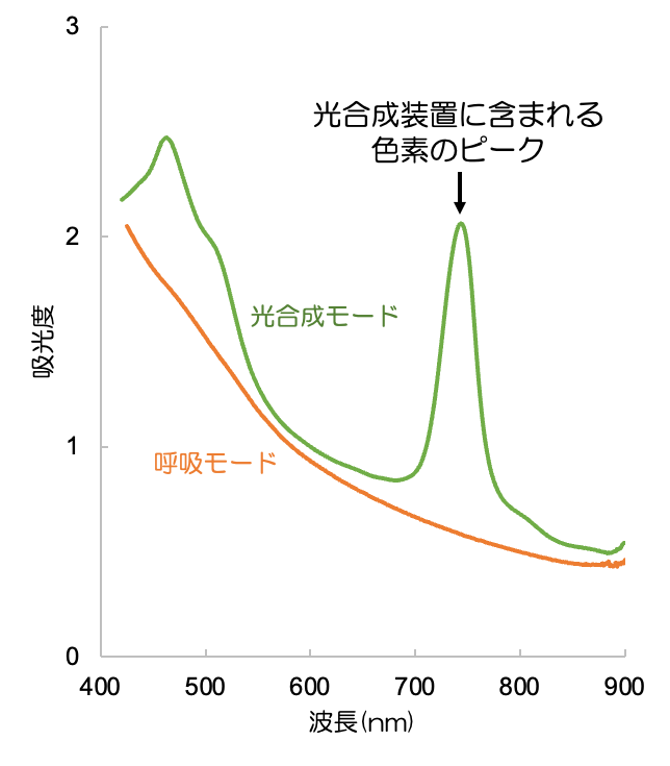
一方 C. aurantiacus は光合成条件(嫌気・明所)で生育できるだけでなく、呼吸条件(好気・暗所)でも生育できます。2つの条件でそれぞれ培養した C. aurantiacus は、それぞれ細胞の状態が大きく異なっており、光合成モード時の吸収スペクトルを測定すると、740nm付近にクロロソームに含まれるBChl c 由来の吸収ピークが見られます(図3:緑線)。しかし呼吸モード時では740 nmのピークが見られないことから(図3:橙線)、光合成しないときは光合成装置を当然つくらないという事がわかります。そこで、光合成装置が無い呼吸モードの細胞が、どのように光合成モードに変わるのか?という観点から、その移行期の発現タンパク質の変化を解析すれば、光合成装置をイチから作るための仕組みやプロセスが明らかになるのではないかと考えました。
-
図3 光合成生育時(緑)と呼吸生育時(橙)における C. aurantiacus の吸収スペクトル
光合成生育時には740nm付近に光合成色素(バクテリオクロロフィル c 会合体)由来の吸収ピークが見られる。しかし呼吸条件ではそれが見られない。
図4は培養実験の流れを示しています。まず遮光した大容量(10L)のジャーファーメンターを用いて C. aurantiacus を呼吸条件で前培養しました。通気・撹拌し続けることで十分な酸素を送り込み、細胞の状態を安定させています。3日間の培養後、気相のガスを窒素に置換して密栓し、酸素を少しだけ(10%)添加してから*注2、光を当てて光合成培養をスタートしました。光合成培養開始後、経時的にジャーファーメンターから培養液の一部を分取し、吸収スペクトルの測定、発現タンパク質の解析、色素組成の分析を行いました。

-
図4 ジャーファーメンターを用いた C. aurantiacus の培養
培養液がオレンジ色(呼吸モード)から緑色(光合成モード)に変わる。
【研究結果1: C. aurantiacus の細胞増殖と色素含有量の変化】
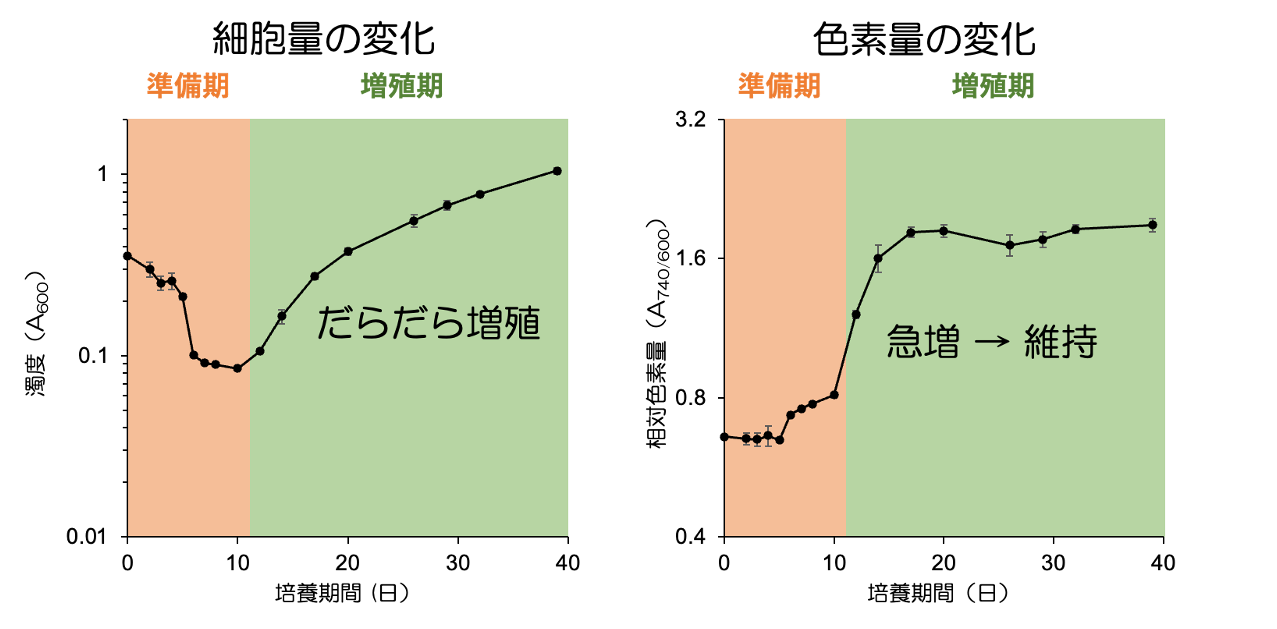
呼吸モードの C. aurantiacus を光合成条件に移すと、細胞はどのように変化していくのでしょうか。図5に示しているのは、培養液の細胞量の変化(左図)と総色素量の変化(右図)です。光合成条件に移した直後の細胞は細胞分裂をせず(“準備期”)、しばらく経ってから増殖を再開することがわかりました。増殖を始めるタイミングで、色素量は急激に増加することもわかりました。
-
図5 C. aurantiacus の増殖曲線(左)と細胞あたりの色素量変化(右)
培養期間は、光を当て始めてからの日数を示す。
【研究結果2: 経時的プロテオーム解析による光合成タンパク質の発現変動】
C. aurantiacus はゲノム上に約3900個の遺伝子を持っています。本研究ではJAMSTECにある高感度な質量分析計を使用することで、全遺伝子の3分の2にもなる約2600種類もの遺伝子に由来するタンパク質を検出することに成功しました。また、光合成に関わるタンパク質もほとんど検出できていることがわかりました。
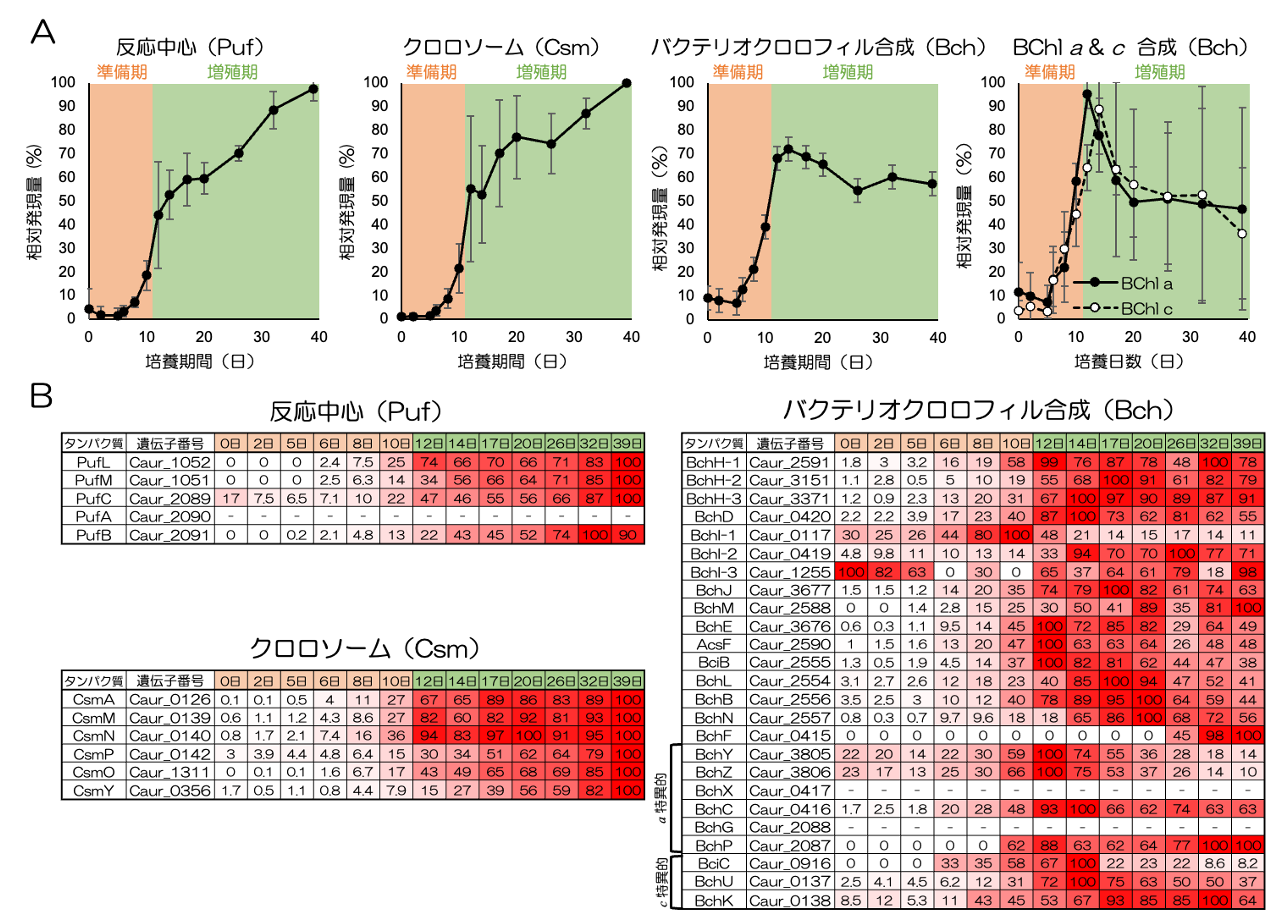
図6は光合成に重要な反応中心・クロロソーム・BChl合成に関わるタンパク質群の発現量の変化を示しています。反応中心(Pufタンパク質)とクロロソームタンパク質(Csmタンパク質)は細胞増殖が始まる少し前(明所培養10日頃)から発現量が増加し、培養終了まで継続的に発現量が増加していきました。一方BChl c とa を合成するタンパク質は発現増加のタイミングはPuf, Csmタンパク質とほとんど同じですが、増殖し始めてからすぐに(培養14日目)発現量が最大になり、それ以降は維持または減少する傾向がありました。
C. aurantiacus は2つの色素(BChl a とc)にそれぞれ専用の合成酵素を持っているので、それぞれをピックアップして同様に発現変動を解析したところ、BChl a 専用酵素では培養12日あたりで、BChl c 専用酵素では培養14日目あたりで発現量が最大になっており、発現機序にズレがありました。つまり光合成モードになった細胞では、増殖初期に色素を一気に合成し、さらにBChl c よりもBChl a の方を先に合成すると考えられました。PufそしてCsmタンパク質は色素量の増加が止まっても継続して合成されることから、ある程度出来上がった光合成装置に追加挿入される、および/もしくは合成された色素を有効活用しながらタンパク質のターンオーバーが起きていることが示唆されました。
-
図6 C. aurantiacus の光合成移行期における光合成タンパク質の発現変動
A)反応中心(Puf)、クロロソーム(Csm)、全ての色素合成タンパク質(Bch)、BChl a と c にそれぞれ専用なタンパク質の相対発現量変化。タンパク質の発現が検出されたPuf (4/5個), Csm (6/6個), 全てのBchタンパク質 (23/25個)、BChl a 専用(4/6個)、BChl c 専用(3/3個)の発現量の平均を示す。
B)Puf、Csm、Bchタンパク質ごとの相対発現量変化。表内の100(%)は全てのサンプル分取日の中で最も発現量が高かった日であることを示す。視覚的にわかりやすいよう発現量が高くなればなるほど赤が濃くなるようにしている。
【研究結果3: 光合成色素の成分分析】
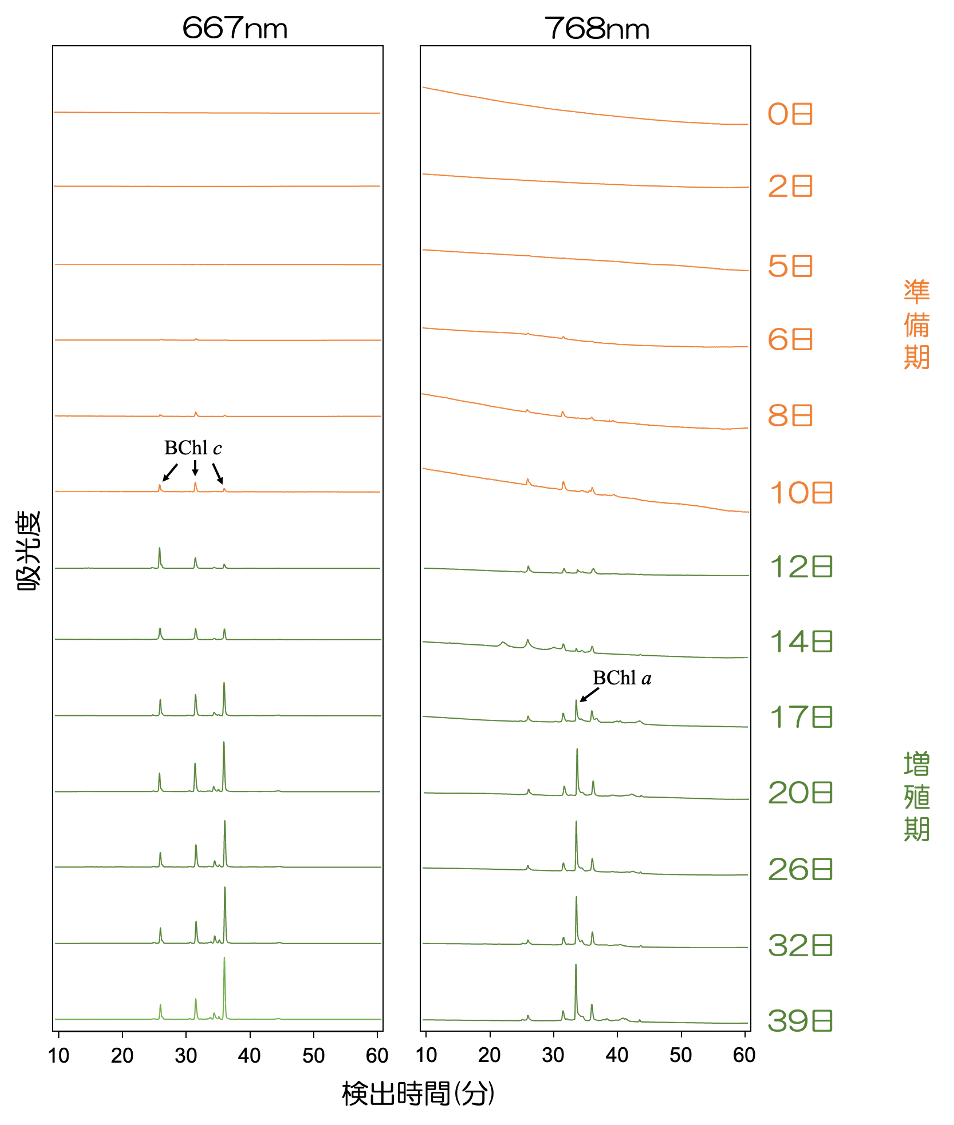
ここまでプロテオーム解析手法によってBChl a 専用酵素のほうがBChl c 専用酵素よりも少しだけ先に発現量が最大になることがわかりました。そこで、実際に C. aurantiacus の細胞から色素を抽出して、高速液体クロマトグラフィー(HPLC)を用いて成分組成を詳細に解析しました。
図7は、左側がBChl c を効率よく検出できる波長(667 nm)、右側はBChl a を効率よく検出できる波長(768 nm)におけるHPLCクロマトグラムになっています。BChl c は8日目には検出することができています。一方、BChl a は12日目以降に初めてピークが検出されています。つまり、呼吸から光合成に移行する C. aurantiacus 細胞内では、BChl a よりも先にBChl c が合成・蓄積することが示され、プロテオーム解析の結果とは異なる結果になりました。これは、BChl c 専用酵素の方がBChl a 専用酵素に比べ少量でもよく働くことで、発現量がまだ少ない時期でもBChl c を生産出来ているのかもしれません。もしくは、BChl c はクロロソーム内部に蓄積しますが、BChl a は反応中心やベースプレートに結合する、といった色素の局在性の違いが原因かもしれません。
-
図7 HPLCによる色素溶出プロファイル
波長667 nmは移動相におけるBChl c モノマーの吸収極大(Qy)、768 nmはBChl a モノマーの吸収極大(Qy)であり、それぞれの色素の合成パターンを見やすくするために切り出している。768 nmにおいてもBChl c の吸収は一部見えることに注意されたい。
【考察: C. aurantiacus の光合成装置の形成プロセス】
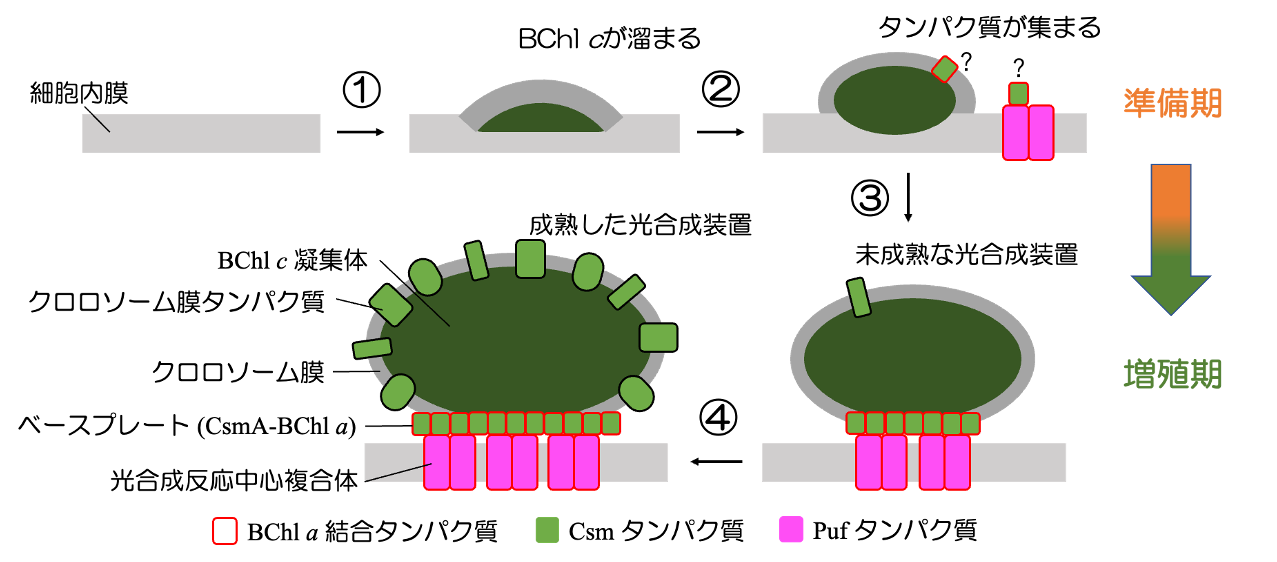
以上の結果をもとに、図8のような C. aurantiacus の光合成装置の形成プロセスを考案しました。
- ① HPLCによる解析の結果から、光合成装置の初期合成プロセスにおいてBChl cの蓄積が最初に進むと考えられます。BChl c は疎水性物質なので、細胞質ではなく細胞膜内部に局在すると推測されます。
- ② ある程度蓄積したBChl c 周辺にベースプレートや反応中心タンパク質が凝集していきます。どのように凝集するかはまだよくわかっていませんが、色素―タンパク質間の特異的な相互作用などが考えられます。
- ③ ベースプレートや反応中心タンパク質の蓄積が進み、BChl c を含む袋構造が細胞膜から分離します。袋構造はベースプレート部分を基底部として反応中心と結合します。
- ④ 更にクロロソームタンパク質や反応中心タンパク質が合成され組み込まれることで、成熟した光合成装置が作られる。
-
図8 C. aurantiacus の光合成装置合成モデル
① から④ の数字は上記の説明文と対応。
【おわりに】
今回の研究によって、C. aurantiacus の光合成装置はBChl c の蓄積にはじまり、未成熟な光合成装置の合成、そして成熟というプロセスを経て組み立てられるというモデルを提唱しました。これは呼吸から光合成モードへの移行期に着目し、細胞内の発現タンパク質や色素の経時変化を逐次的に解析したからこそ得られた成果です。更に研究が進み光合成タンパク質間の相互作用などが明らかになれば、生物由来の集光デバイスの応用に繋がっていくと考えています。
今後は、電子顕微鏡を駆使した細胞内の観察や、分子遺伝学的手法を開発することで、光合成装置の発達プロセスの詳細な分子メカニズムを明らかにしていきたいと考えています。
- *参考文献[1] Khaledian, E.; Brayton, K.A.; Broschat, S.L. A Systematic Approach to Bacterial Phylogeny Using Order Level Sampling and Identification of Hgt Using Network Science. Microorganisms 2020, 8(2), 312.
- *参考文献[2] Blankenship, R.E. Early Evolution of Photosynthesis. Plant Physiol. 2010, 154, 434–438
- *注1 「門:もん」とは生物分類学における基本的分類階級の一つ。現在、細菌(バクテリア)ドメインでは42の門 (Phylum)が正式に記載されている。さらにそれら以外にも、次世代シーケンサーによるメタゲノム解析で見いだされた未培養・未同定の系統群が Candidatus phylum として提唱されている
- *注2 【実験上のよもやま話】
実験方法のところでサラッと触れていますが、呼吸条件で培養した後に光合成条件に切り替える時に、完全に嫌気(窒素ガス充填)にせずにあえて酸素を少し添加しています。光合成モードにさせたいのに、なぜわざわざ酸素をいれたのか?
実は以前、呼吸モードの C. aurantiacus を完全嫌気の光合成条件に移して培養したことがありました。しかし1ヶ月、2ヶ月と待っても一向に生えてくる気配がありませんでした。いろいろと思考を巡らせた結果、あることに気づきました。
呼吸モードの C. aurantiacus にはまだ光合成装置がありません。そんな細胞が完全嫌気の光合成条件に移されるとどうなってしまうのでしょうか?光はあっても光合成装置がないので光合成でエネルギー生産は出来ない。しかも酸素もなくなったので呼吸によるエネルギー生産もできない。できることがないため、呼吸モード中の C. aurantiacus は光合成器官を作り始めるためのエネルギーを作れないというジレンマに陥ってしまったのでは?と考えました。そこで光合成条件に移す時に酸素を少しだけ入れてあげることで、光合成モードに切り替わるために必要なエネルギーを作ることができるように工夫しました。その結果、準備期間が少し長くはありますが、再現的に光合成培養することができたのです。なお、添加した少量の酸素は光合成生育が進むうちに消費されて無くなることもいくつかの実験結果から示唆されました。
ページ先頭へ戻る
研究内容紹介を読んでみて Q&A
★高井P長:
酸素呼吸で培養しているときはエネルギー源・炭素源は酵母エキスのような栄養たっぷりのエサを与えてるんですかね?光合成に切り替わった後は、エネルギーは光エネルギーだとして、炭素源は何を使ってるんでしょうか?
-
酸素呼吸時の主なエネルギー源・炭素源は酢酸で、ごく少量の酵母エキスも入っています。光合成に切り替える時に、炭素源として酢酸を追加で添加しています。Chloroflexus aurantiacus は酵母エキスだけでも増殖できますが、培養したときの細胞状態が最も安定するのが酢酸なので、今回は酢酸を使用しています。
★高井P長:
今回の Chloroflexus aurantiacus はII型反応中心の光合成細菌で、しかも嫌気光合成(従属栄養?)と好気酸素呼吸(従属栄養?)のダブルエッグ丼を切り替えることができる「ずるいよ〜ずるいよ〜」な微生物ですが、I型反応中心の光合成細菌もこのような光合成と呼吸を切り替えるチート技持ってるんですかね?
-
I型反応中心をもつ光合成細菌は4つの系統群(Chlorobiota, Acidobacterota, Chloroflexota, Bacillota)から見つかっていますが、現時点でI型反応中心を持つ光合成細菌のなかで光合成と呼吸の両方を使う種は単離されていません。
★高井P長:
ちなみにI型反応中心とII型反応中心はどっちが古いの?
-
これは数十年前から議論されている大問題ですが、現在もなお解決していません。
タンパク質の結晶構造解析からI型反応中心はホモダイマー、II型反応中心はヘテロダイマーであることが明らかになっています。タンパク質は通常ホモダイマーからヘテロダイマーに進化するという性質から、これまではI型反応中心のほうが古いと考えられてきました。
しかし近年では、最初はI型でもII型でもない起源的な反応中心があり、そこからduplicationと機能分化を経て現在の2種類の反応中心になったという説も提案されています。
★高井P長:
結構どんくさいことで有名な河合くんがこんなエレガントな実験と解釈を叩き出すなんて人は見かけによりませんね(笑)。
-
このような成果を上げることができたのも受入研究者の塚谷さんをはじめ、島村さん、嶋根さん、宮崎さん、そしてやらかしても生暖かい目で見守ってくださった高井さんのおかげでございます。この場を借りて感謝申し上げます。
↑(編集者註:模範回答of模範回答すぎません?笑)
★高井P長:
クロロソームという細胞内小器官みたいなものを作るのは結構なエネルギー・手間暇コストがかかりそうなんですが、全ての光合成細菌が光合成をするためにこのような特殊な装置を必要とするのでしょうか?
植物と違って微生物(バクテリア)はサイズが小さいために実は「集光」がボトルネックになりそうな気がする。ほら太陽光発電ってメガソーラーみたいに広い土地必要やん。
微生物はカラダがちっちゃいので膜を介した電子伝達は得意ですが、実は集光が苦手で単にアンテナ色素を細胞内とかペリプラズムに漂わせておくだけではエネルギーを集められないっていうことはありますかね?
-
クロロソームを持たない光合成細菌(Pseudomonadota, Candidatus Eremiobacterota, Bacillota, Gemmatimonadota)では、クロロソームとは異なるアンテナ装置を使う種類も知られています。Pseudomonadota の光合成細菌では、ひとつあたりの集光力が低い膜貫通タイプの小さいアンテナ装置 (Light-harvesting complex II) が内膜上にたくさん埋め込まれています。Bacillota の光合成細菌はそもそもアンテナ装置を持っていませんが、この場合は反応中心に直接結合しているいくつかのバクテリオクロロフィルがアンテナとして機能します。
アンテナ色素を細胞内の一箇所に集中させておく理由は、集光の問題ではなく吸収したエネルギーの伝達にあると思います。アンテナ装置内部では、色素はパッキングされるか適切な向きに配位されているため、吸収したエネルギーはいわばバケツリレーのように色素分子を伝って反応中心へと運ばれます。しかし色素が細胞内やペリプラズムなどに漂っていると、励起エネルギーを反応中心に正しく伝達できません。また、フリーで存在する高エネルギー状態の色素は活性酸素種発生の原因にもなります。活性酸素種はDNA損傷などを引き起こし非常に危険ですので、色素を膜やタンパク質の中に埋め込むことでコントロールする必要があるのだと思います。
★読者A:
呼吸モードから光合成モードへの切り替わり時に、光合成装置が発現していくのを見ていますが、逆に光合成モードから呼吸モードへ変わると光合成装置関連のタンパク質ってどれくらい維持され続けるものなんでしょうか?要らなくなったらすぐに捨てられちゃう(消化?分解?される)?
そもそも1回作られた光合成装置自体の寿命(壊れるまで)ってどれくらいか分かっていたりしますか?
-
光合成細菌の光合成装置がどれくらい維持されるか、またその細胞内での寿命についてはよくわかっていません。そもそも光合成細菌に光合成装置を積極的に分解する仕組みが備わっているのかどうかも確かめられていないのです。今回の逆パターンである光合成モードから呼吸モードへの移行期におけるタンパク質発現を解析すればヒントが得られるかもしれませんので、続報をお待ちいただければと思います。
★読者A:
光合成と呼吸の両方できるのって環境適応的に?すごくお得な気がしたのですが、細菌みんなが両方できるようになっていないのは何かデメリット(理由)があるからなのでしょうか?
-
たしかに光合成と呼吸を両方できたほうがお得に見えますが、そのような光合成細菌は実は過酷な環境で生きるために複数の能力を獲得したに過ぎないというのが私の見解です。
例えば安定して光が当たり、かつ無酸素な環境があったとして、そのような場所では光合成細菌は呼吸をせず光合成だけで生きていけます。呼吸能を持っていると無駄なだけでなく余計な維持コストがかかるので、そのような遺伝子は進化の過程でなくなっていくのです。
しかし、光合成生物が常に光合成だけをできる環境は限定的です。有酸素と無酸素条件が入り交じる環境に住む光合成細菌は無酸素のときだけ光合成するのだけでは効率が悪いため、酸素呼吸を併用するという戦略をとったのではないかと考えています。
ページ先頭へ戻る
