プレスリリース
国立研究開発法人海洋研究開発機構
国立大学法人高知大学
人為汚染物質である人工ナノ粒子を環境から分離する
新たな生物浄化作用の発見
―有孔虫における酸化チタンナノ粒子の
毒性・解毒作用を解明―
1. 発表のポイント
- ◆
- 酸化チタンナノ粒子(※1)は、2021年以降米国ハワイ州での販売・流通が規制された日焼け止めの代替材料として注目されているが、同時に新たな人為汚染物質であるとの指摘がある。今回の研究で、この酸化チタンナノ粒子が生物にもたらす毒性とその解毒作用について、有孔虫(※2)を用いて明らかにした。
- ◆
- 有孔虫は、細胞毒性のある酸化チタンナノ粒子曝露下での代謝過程で、酸化チタンナノ粒子を内包した粘液を細胞外へ排出することで、解毒を行っていることがわかった。また、排出された有孔虫粘液は、比重が軽いため環境から分離・回収が容易である。
- ◆
- この研究成果は、有孔虫粘液を用いることによる、環境からの除去が難しかった人工ナノ粒子分離技術の可能性を示唆しており、今後期待される環境イノベーションの基本的な知見となる。
【用語解説】
- ※1
- 酸化チタンナノ粒子:粒径100 nm以下の酸化チタン微粒子で紫外線遮断性、光触媒機能などがあり、日焼け止めや衣類、空気清浄機フィルターなどに使用されている。塗料、コーティング剤としても使用されている。
- ※2
- 有孔虫:単細胞真核生物の仲間で、沿岸〜深海の海底や海洋表層〜深層に分布する。重金属汚染がある沿岸堆積物にも生息している。身近な仲間にホシズナがある。
2. 概要
国立研究開発法人海洋研究開発機構(理事長 大和 裕幸、以下「JAMSTEC」という。)超先鋭研究部門の石谷佳之特任研究員らは、単細胞真核生物である有孔虫を酸化チタンナノ粒子の溶液(培地)に曝露(浸した状態)し、共焦点レーザー顕微鏡(※3)と発現遺伝子比較解析(※4)を用いて調べた結果、酸化チタンナノ粒子がもたらす生物への毒性とその解毒作用に関する代謝過程を明らかにしました。また、その過程で有孔虫が、人為汚染物質と指摘されている酸化チタンナノ粒子を環境から分離する能力を有していることを発見しました。
酸化チタンナノ粒子の毒性評価はこれまで細胞観察レベルで行われてきましたが、細胞毒性のメカニズムを明らかにするには多細胞生物では代謝ネットワークが複雑であり、通常の単細胞真核生物では小さすぎて細胞観察が困難でした。そこで、単細胞真核生物の中でも体サイズが非常に大きい(約0.3 mm)有孔虫を研究対象に選び、酸化チタンナノ粒子の毒性評価を行いました。
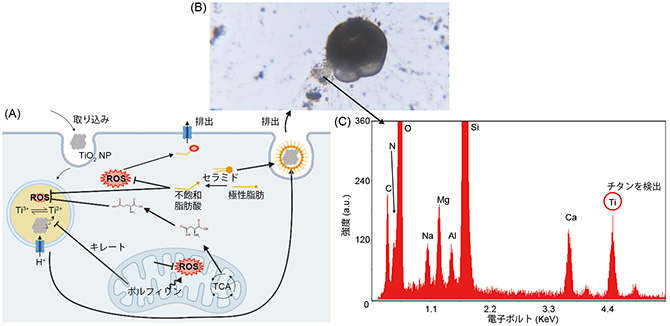
図1 本研究の概要。(A)酸化チタンナノ粒子が有孔虫に与える毒性・解毒作用を復元した。この結果から酸化チタンナノ粒子をセラミドに内封して排出されることが予測された。(B) 酸化チタンナノ粒子暴露24時間後以降の有孔虫。浮力のある粘液を排出している。(C)粘液をエネルギー分散型X線分光法で解析した結果、チタンが内封されていることが証明された。
本研究では、石谷佳之特任研究員が独自に作り出した有孔虫Ammonia venetaの継代培養株(※5)を酸化チタンナノ粒子(1 ppm)が含まれる海水培地に曝露し、経時変化を共焦点レーザー顕微鏡観察、各曝露時間と通常状態の発現遺伝子比較解析を行いました。この結果、曝露24時間後には毒性による代謝が鈍化して細胞は通常状態に近い状態に戻り、有孔虫の細胞内に取り込まれた酸化チタンナノ粒子は有機物に内封され、粘液として細胞外へ排出されることがわかりました(図1)。この粘液は環境から酸化チタンナノ粒子を分離し、比重が海水よりも軽いため回収も容易です。つまり、有孔虫を用いた人工ナノ粒子分離が可能であることがわかりました。
本成果は、「Environmental Pollution」に5月16日付け(日本時間)で掲載される予定です。なお、本研究はJSPS科研費18KK0203、18K03820及びJAMSTECが進める「地球環境変動が及ぼす影響評価と海洋物質循環の理解」の研究に基づいており、人為汚染物質などの人類起因型海洋危機を解決するための海洋生態系機能の探索と理解に向けた研究の一環として実施されたものです。
- タイトル:
- Fascinating strategies of marine benthic organisms to cope with emerging pollutant: titanium dioxide nanoparticle
- 著者:
- 石谷佳之1、Caterina Ciacci2、氏家由利香3、多米晃裕4、Mattia Tiboni2、谷藤吾郎5、稲垣祐司6、Fabrizio Frontalini2
- 所属:
- 1. 海洋研究開発機構、2. ウルビノ大学、3. 高知大学海洋コア国際研究所、4. マリンワークジャパン、5. 国立科学博物館、6. 筑波大学計算科学研究センター
- DOI:
- 10.1016/j.envpol.2023.121538
【用語解説】
- ※3
- 共焦点レーザー顕微鏡:レーザーを光源とした顕微鏡で焦点が合った面だけの光を選択して像を再構成するため、焦点距離が一様でない厚みのある試料を高解像度に撮影できる特長を持つ。
- ※4
- 発現遺伝子比較解析:遺伝子の発現量を統計的に比較することで、サンプル間の代謝の違いを検出する手法。
- ※5
- 継代培養株:培養容器内で増殖した特定の生物を継続的に植え継いだもの。
3. 背景
人工ナノ粒子は電子部品/製薬/衣料品/化粧品など幅広く用いられており、その消費量が年々増加しています。酸化チタンナノ粒子は、全世界で生産される人工ナノ粒子の中で第2位(68,000トン/年:2016年)の量であり、環境への流出量も沿岸の堆積物で最も多い(123mg/kg:2020年海洋堆積物)と推定されています。また、2021年にサンゴに有害な成分としてハワイで禁止にされたオキシベンゾンやオクチノキサートの代替品として日焼け止めに使用され、環境への流出量は今後、増加の一途を辿ると考えられています。しかし、酸化チタンナノ粒子には細胞毒性があることが報告されており、新たな環境汚染源として注目されています。このような新たな環境汚染源の毒性を理解することや環境からの回収方法の開発は、人類にとって急務の課題です。
酸化チタンナノ粒子の毒性は土壌動物や淡水藻類でよく調べられており、活性酸素(ROS)や中性脂肪の増加が起こることがわかっています。細胞内のROSは不飽和脂肪酸を酸化し、脂質過酸化反応を起こし、遺伝子毒性、摂食/繁殖障害を引き起こします。このような細胞毒性は明らかになっていますが、どのような代謝経路を介するのかという細胞毒性のメカニズムはわかっていません。それは多細胞生物の複雑な代謝ネットワークの全容解明や、体サイズの小さな単細胞真核生物の観察が技術的に難しかったことが理由でした。
そこでJAMSTECでは、単細胞真核生物の中でも体サイズが非常に大きい(約0.3 mm)有孔虫を研究対象に選び、酸化チタンナノ粒子の毒性評価を行いました。
4. 成果
今回の研究では、沿岸の堆積物に生息する単細胞真核生物である有孔虫Ammonia venetaの継代培養株を、酸化チタンナノ粒子(粒径: 25 nm)(Aeroxide®)1 ppmの海水培地に曝露し、経時変化(1, 6, 24時間後)を観察しました。細胞変化は曝露後の個体を蛍光色素(CellROX® Green, Acridine Orange, Nile Red)でマーキングし、共焦点レーザー顕微鏡で観察しました。それと並行して、曝露後の個体を1個体ずつ発現遺伝子解析し、酸化チタンナノ粒子に曝露していない個体(コントロール群)と比較解析することにより酸化チタンナノ粒子の毒性に対する代謝系の復元を行いました。
共焦点レーザー顕微鏡観察の結果、曝露1時間後に細胞毒性に関係するROSが著しく多くなり、脂肪の種類が変化しました(図2A,B,D,E)。また、細胞内に酸性小胞も確認されました(図2C,F)。発現遺伝子比較解析から、有孔虫は細胞内に酸化チタンナノ粒子を取り込み、酸化チタンナノ粒子を取り込んだ小胞を酸性にすることで酸化チタンナノ粒子の表面電荷が強まり、フェントン反応(※6)によってROSが発生することが示唆されました。また、ミトコンドリアのポルフィリン(※7)生合成の過程でROSが発生していることが示唆されました。また、これらの過剰なROSを除去するために有孔虫は極性脂肪を不飽和脂肪酸に代謝し、脂質過酸化反応を起こしていることがわかりました。
更にROSや過酸化脂肪酸は周りの物質を酸化し、生体損傷を引き起こすため、グルタチオンペルオキシターゼ(GPX、※8) や亜硫酸オキシターゼ(SUOX、※9)で活性酸素除去を行っていることがわかりました。また、ROSを発生させていたポルフィリンは小胞内のフェントン反応の発生源である遷移金属(※10)を除去するために代謝している可能性が示唆されます(図2G)。
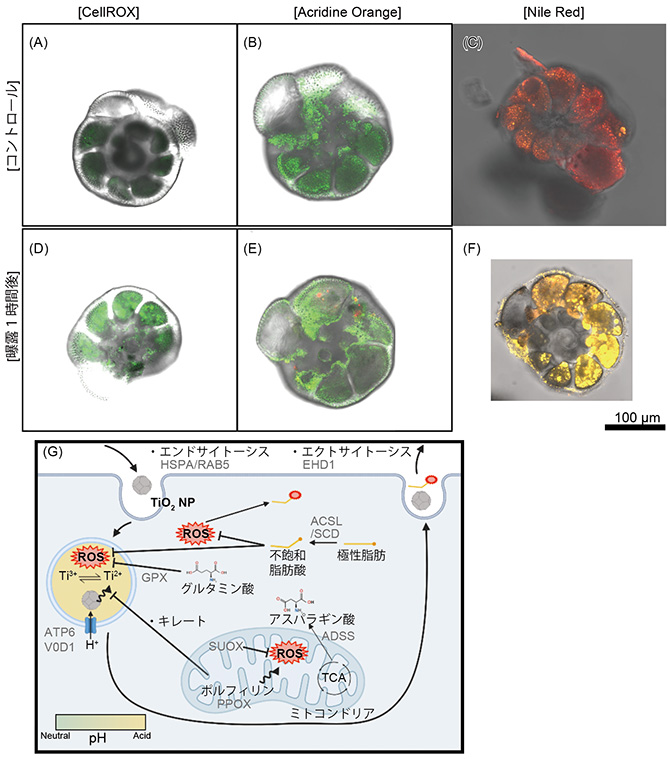
図2 (A-C)コントロール(曝露なし・通常状態)と(D-F)曝露1時間後の個体を蛍光色素(CellROX® Green, Acridine Orange, Nile Red)で標識した個体を共焦点レーザー顕微鏡で観察したもの。(A,D)CellROX® GreenはROSを緑色にマーキング、 (B,E) Acridine Orangeは小胞/酸性小胞を緑色/赤色にそれぞれマーキング、(C,F) Nile Redは極性脂肪/中性脂肪を赤色/黄色にそれぞれマーキングする。曝露1時間後に急激な細胞毒性が確認された。(G)発現遺伝子比較解析の結果をまとめたもの。活性酸素の発生源と除去がどのように行われているかがわかる。
その後、更に観測を継続したところ、曝露6時間後にはROSが少なくなり、ROSを発生させているミトコンドリアが一部、細胞外へ排出されている様子が観察されました(図3A)。
中性脂肪については引き続き多く確認されるものの、一部は細胞外へ排出されました(図3C)。また、海水中の酸化チタンナノ粒子を光散乱法(※11)で解析した結果、2 µm程度に凝集していることがわかりました。発現遺伝子比較解析の結果、GPXの基質であるグルタミン酸が減少した為にGPXによるROSの除去は鈍化しており、それを回復するためのグルタミン酸の代謝が活発になりました。また、ROSにより過酸化された過酸化脂肪酸は生物異物解毒過程で細胞外へ排出されていることもわかりました(図3D)。
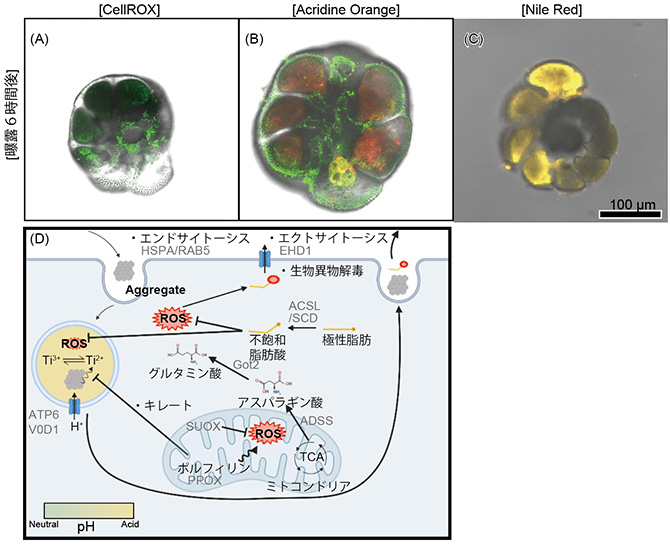
図3 (A-C)曝露6時間後の個体を蛍光色素(CellROX® Green, Acridine Orange, Nile Red)で標識した個体を共焦点レーザー顕微鏡で観察したもの。(A) ROSが少なくなり、一部、細胞外へ排出されている。(C)不飽和脂肪酸が増加し、一部、細胞外へ排出されている。(D)発現遺伝子比較解析の結果をまとめたもの。ROSの代謝が一部、変化し、過酸化脂質の排出が見られる。
更に曝露24時間後にはROSが少なくなり、ほぼ通常状態と同じになり(図4A)、酸性小胞も確認されなくなりました(図4B)。ただし、中性脂肪はまだ多く確認されました(図4C)。発現遺伝子の結果を解析した結果(図4D)、曝露24時間後の個体は、毒性による代謝が弱まり、通常状態に近い状態にあることがわかりました。また、発現遺伝子比較解析の結果、小胞の酸性化は鈍化し、ROS発生を抑えていることがわかりました。また、不飽和脂肪酸によるROS除去は鈍化し、GPXによるROS除去が活性化されました。一方で、セラミド(※12)生合成が活性化し、生物異物のカプセル化に関わる遺伝子の発現量が活発化しました。これは、有孔虫は酸化チタンナノ粒子を異物と認識し、セラミドと共に細胞外へ排出している可能性を示唆するものです(図4E)。
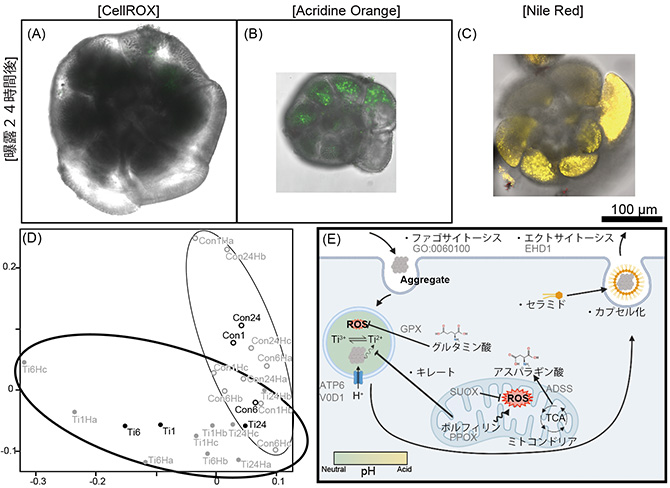
図4 (A-C)曝露24時間後の個体を蛍光色素(CellROX® Green, Acridine Orange, Nile Red)で標識した個体を共焦点レーザー顕微鏡で観察したもの。(A) ROSがほぼ通常状態と同じになり、(B)酸性小胞もほぼ見られなくなった。(C)不飽和脂肪酸は多いままであった。(D)発現遺伝子を多次元尺度構成法で解析した結果。灰字は各条件の各検体で、黒字が各条件で平均化したもの。曝露24時間後(Ti24)が通常状態(Con1/6/24)と同じ状態に戻っていることがわかる。(E)発現遺伝子比較解析の結果をまとめたもの。小胞の酸性化が鈍化し、GPXによるROS除去が活発化する。また、セラミド生合成と生物異物のカプセル化が活発化する。
これらの分析結果から、有孔虫Ammonia veneta継代培養株が酸化チタンナノ粒子に耐性があることが確認されたので、その解毒プロセスを確認するために、曝露下での長期培養を行いました。その結果、培養中に粘液を排出し(図5A)、そのまま細胞分裂することが確認されました。排出された粘液をアガロースゲル(※13)内に固定し、走査型電子顕微鏡観察し(図5B)、エネルギー分散型X線分光法で元素組成を調べたところ、粘液内からチタンが検出されたことがわかりました。
この粘液は非常に浮きやすい性質を有しており、曝露24時間後の発現遺伝子比較解析の結果、セラミドでカプセル化されたものと考えられます。こうした結果は、有孔虫の機能を活用することで、海洋堆積物からの酸化チタンナノ粒子除去に役立つ可能性を示唆するものです。

図5 (A)長期培養した有孔虫。細胞外に粘液を排出している様子が観察された(矢印部)。(B)粘液をアガロースゲル内に固定し、走査型電子顕微鏡観察し、(C)同じ画像をエネルギー分散型X線分光法で解析し、チタンの分布をマッピングしたもの。粘液内にチタンが内包されていることがわかる。
【用語解説】
- ※6
- フェントン反応:遷移金属と過酸化水素が反応し、価数の増えた金属になりROSを発生させる。
- ※7
- ポルフィリン:呼吸でエネルギーを作るミトコンドリアで働くヘムの前駆体で、生命活動に不可欠な生体物質。
- ※8
- グルタチオンペルオキシターゼ(GPX):グルタチオンと過酸化水素を反応させ、活性酸素を除去する酵素。
- ※9
- 亜硫酸オキシターゼ(SUOX):硫酸塩と過酸化水素を反応させ、活性酸素を除去する酵素。
- ※10
- 遷移金属:元素周期律表3族から11族までの第4周期以降の元素。とりうる酸化数が多数存在し、単体、化合物ともに触媒として働くものが多い。
- ※11
- 光散乱法:溶液に照射された可視光の入射光と同じ波長をもつ弾性散乱光の強度や、その強度の時間変化を観測する手法。
- ※12
- セラミド:細胞の間を埋める細胞間脂質。皮膚の角質層に存在し、水分を保つ機能や外来物質の侵入を防ぐバリア機能もある。
- ※13
- アガロースゲル:寒天の主要な多糖成分であるアガロースをゲル化したもので、ゲルの網状構造を利用して核酸の分離に広く利用されている。
5. 今後の展望
今回の研究成果は、酸化チタンナノ粒子がもたらす細胞毒性について、実際の代謝経路や、どのように解毒しているかを明らかにしました。この結果は今後、細胞毒性を軽減した材料開発や、細胞毒性を抑える薬の開発の基本的な知見となると考えられます。
また、有孔虫は粘液を用いて環境中から人工ナノ粒子を分離することから、この生物浄化作用を応用することで、非常に微細であるため、これまで環境からの除去が難しかった様々な人工ナノ粒子を環境から除去できる可能性があり、今後、有孔虫を用いた環境イノベーションが期待されます。
近年、世界的に喫緊の問題となっているプラスチックごみは、海洋に流出し、マイクロ〜ナノサイズに破砕され、海洋中に分解されることなく漂っています。人工ナノ粒子はサイズが小さくなることで、表面電荷が強くなると同時に毒性が高くなることが知られており、プラスチックもマイクロ〜ナノサイズへとサイズが小さくなるに従い、毒性が高くなることが知られています。
今後、今回得られた研究手法を発展させ、有孔虫を用いたナノプラスチックの細胞毒性を明らかにしていく予定です。有孔虫粘液による生物浄化作用が酸化チタンナノ粒子に限定されるものでなければ、本研究成果を基盤とした大きな環境イノベーションへの展開が期待されます。
- (本研究について)
- 海洋研究開発機構 超先鋭研究部門
- 特任研究員 石谷 佳之
- 高知大学 海洋コア国際研究所
- 教授 氏家 由利香
- (報道担当)
- 海洋研究開発機構 海洋科学技術戦略部 報道室
- 高知大学 海洋コア国際研究所 海洋コア室