プレスリリース
2015年 3月 17日
独立行政法人海洋研究開発機構
遺伝子発現システムの脆弱性を利用した細胞の増殖抑制に成功
~医療分野等への応用も期待~
1.概要
独立行政法人海洋研究開発機構(理事長 平 朝彦、以下「JAMSTEC」という)海洋生命理工学研究開発センターの小林英城主任研究員は、低頻度コドン( ※1)で構成された緑色蛍光タンパク質(Green Fluorescent Protein:以下「GFP」)(※2)を人工合成し、これを細菌やがん細胞、ウイルス等内で発現(遺伝情報に基づいてタンパク質を合成)させることで、それらの増殖を種類を問わず(非特異的に)抑制することに成功しました。
細胞が正しく増殖するためには、その設計図であるDNAが正確に複製される必要があります。この複製の過程で遺伝子がDNAを構成するタンパク質を合成します(翻訳される)が、タンパク質の材料であるアミノ酸を正しく配列させるのに必要なものがコドンです。このコドンには様々な種類がありますが、個々の使用頻度には偏りがあります。このうち使用頻度の低いコドン(低頻度コドン)について、これに対応するアミノ酸を運ぶ役割を果たすトランスファーRNA(tRNA)の濃度が低いことから、低頻度コドンと低濃度tRNAとの分子間ネットワーク(生体を構成するタンパク質等の生体高分子同士の相互作用)が、一般的なコドンと比べて非常に細いことが知られており、これは遺伝子の発現システムにおける「脆弱性」(※3、≒ウィークポイント)と捉えることができます。
小林主任研究員は、この脆弱性に注目し、低頻度コドンで構成された人工合成GFP遺伝子を任意の細胞内で大量に発現させ、この脆弱性を攻撃することで、生物元来の遺伝子発現を抑制し、その結果として生物やウイルスの増殖を非特異的に抑制することに成功しました。
本成果は、細胞レベルの基礎研究段階ではありますが、生理活性(化学物質が生体の特定の生理的調節機能に対して作用する性質)の無い遺伝子でも、低頻度コドンを利用することで、非特異的な抗腫瘍活性や抗ウイルス活性を示す遺伝子へと改変できる可能性を示しており、今後、医療研究機関等と連携して医学的検証を進めることで、症例の少ない病気や癌、そして稀なウイルス感染症などに対する将来的な遺伝子治療への応用が期待されます。
本成果は、科学誌「Applied and Environmental Microbiology」に3月13日付け(日本時間)で掲載されました。
タイトル:Inducible suppression of global translation by overuse of rare codons
著者:小林英城1
1. 海洋研究開発機構 海洋生命理工学研究開発センター
2.背景
深海は太陽光が届かず、海水が大量に存在するという、生物にとって陸上とは全く異なる特殊な環境です。このような環境で深海生物がどのような進化をたどってきたのかを解明するため、遺伝子レベルで研究が進められています。
一般に生物の進化には遺伝子の変化が必須とされ、変化の主な要因は、自然に発生する突然変異(自然突然変異)と生物間における種をまたいだ遺伝子の移動(水平伝播)とされています。ところが、深海においては、水による遮蔽効果で変異を引き起こす紫外線や自然放射線または変異誘発化学物質(亜硝酸等のアミノ酸と結合して変異を誘発する化学物質)等による自然突然変異の機会は少ないことから、小林主任研究員は当初、主に遺伝子の水平伝播が深海生物の進化に重要な役割を果たしていると予想していました。生物間で遺伝子が移動した場合、移動先の生物で発現して機能するかどうかが、生物進化の鍵の一つになります。そこで、小林主任研究員は、移動後の遺伝子の発現は、もともとの生物のコドン使用頻度によって大きく変わると考え、これを実証するため、「低頻度コドン」に着目しました。「コドン」とは、タンパク質の構成性成分である各アミノ酸に対応する3塩基(3つの塩基がセットになったもの)を言い、遺伝子が発現してタンパク質を合成する際に、このコドンが利用されます。64種類あるコドンには、それぞれ対応するアミノ酸が決まっており、このコドンの並び順によってアミノ酸の結合順序が決定されますが、1つのアミノ酸に対して、複数のコドンが存在するため、コドンの使用には偏りが出来ます。この「偏り」は生物の種類によって異なり、あまり利用されない「低頻度コドン」があります。
この低頻度コドンを数多く含む場合、移動した遺伝子の発現量は非常に低くなると言われており、その性質を利用して、遺伝子のコドンを全て低頻度コドンへ変化させたGFP遺伝子を人工的に合成し、その発現量を測定することで、外来遺伝子の進化への影響を検討する予定でした。当初、この最も発現しにくい人工遺伝子の、どこを変えたら発現量が増加するのかについて検討を行う予定でした。しかしながら、予備実験の結果、「最も発現しにくい」という仮説とは異なり、GFP発現による蛍光は観察され、一方では宿主の生育が止まるという予想外の結果が得られました。そこで、この結果を踏まえ、小林主任研究員は、低頻度コドンGFPの発現の仕組みと、これによって宿主が受ける影響及びその応用について、詳しく検討を行いました。
3.成果
遺伝子発現はゲノムDNA情報を、mRNA(メッセンジャーRNA)に転写する「転写過程」とmRNAとリボソームタンパク質が結合し、遺伝情報を翻訳しタンパク質を合成する「翻訳」過程から成り立っています。翻訳過程では、mRNA上のコドンに対応したアミノ酸を運んでくるtRNAが一つ一つ順番に結合してタンパク質を合成します。したがって、途中でコドンに対応するtRNAが不足すると、タンパク質の合成が止まってしまいます。
本研究において、GFP遺伝子発現の影響について検討を行った結果、GFP遺伝子発現により生物内の低頻度コドンに対応するtRNAが独占され、生物本体の遺伝子発現が抑制されていることが分かりました(図1)。
低頻度コドンは低頻度ながらも、ゲノムから発現される遺伝子に一様に存在します。一方、低頻度コドンに対応したアミノ酸を運ぶtRNAの濃度は低いため、遺伝子配列とアミノ酸配列を結ぶ分子間ネットワークが細くなっています。これは遺伝子発現システムにおける「脆弱性」の一つであると考えられます。GFPはこの「脆弱性」に対して、低頻度コドン対応tRNAの大量要求という攻撃を行い、遺伝子発現システムを「フリーズ」させることで、細胞の正常な増殖を妨げます。これは、コンピューターネットワークに対するDoS攻撃(※4)やDDoS攻撃と同様の手法です。小林主任研究員は、この脆弱性を利用して、任意の細胞においてGFP遺伝子を人工的に発現させることにより、さまざまな細菌やウイルスを抑制することができるのではないかと考えました。
3−1低頻度コドンGFP遺伝子発現による細菌およびファージ増殖の抑制
まず細菌の一種、大腸菌でGFP遺伝子発現の検討を行いました。その結果、低頻度コドンGFP遺伝子の発現が認められ、蛍光が観察できました。しかしその一方で、大腸菌の増殖は抑制されました(図2)。また大腸菌内の遺伝子発現も抑制され、例えば周囲の塩濃度変化に対する適応もできなくなりました(図3)。
図1で示したように、本研究で作製した低頻度コドンGFP遺伝子の発現は、「細胞内の全遺伝子発現を抑制できる」と予想されます。そこで、生物だけでなく、ウイルスの増殖も抑制できるか検討を行いました。大腸菌に感染するウイルスは「ファージ」と呼ばれ、ファージ増殖は宿主である大腸菌のタンパク質合成を利用しています。そこで、種属や性質の全く異なる5種類のファージを用いて大腸菌への感染実験を行った結果、低頻度コドンGFP遺伝子の発現は全てのファージの増殖を抑制しました(図4)。弱毒性を示すf1ファージやMS2ファージでは、感染後の大腸菌の数が10%以下に減少していました。
この結果から、低頻度コドンGFP遺伝子は、大腸菌以外の発酵などに利用されている細菌にもファージ耐性を付与できると予想できます。しかし、常に低頻度コドンGFP遺伝子が発現していると、これら有用細菌自体の増殖も止めてしまいます。
そこで、ファージが感染すると低頻度コドンGFP遺伝子が発現する人工遺伝子ネットワークを設計しました。多くの生物は、ウイルスに感染されると、何らかの生理反応を起こします。大腸菌もまた、f1ファージに感染されると、「ファージショックプロテイン」というタンパク質を発現します。そこで、この機構を利用して、ファージショックプロテインと同時に低頻度コドンGFP遺伝子も発現する人工遺伝子ネットワークを構築しました。その結果、本人工遺伝子ネットワークを保持する大腸菌は、f1ファージの増殖を抑え、ファージ感染によって大腸菌が死滅することはありませんでした(図5)。ファージ感染時の生理反応を利用し、細菌に多種多様なファージ耐性を与えることで、細菌を利用した発酵生産時に、ファージによる細菌の死滅を防ぐことが期待できます。
また、この仕組みにより、細胞に感染するウイルスのみの増殖を抑制することが可能となることで、医療分野での有用性も期待できるものとなりました。
3-2ヒト低頻度コドンhu-lgfp遺伝子発現による細胞およびウイルス増殖の抑制
次に本低頻度コドンGFP遺伝子が、ヒトの細胞で同じような増殖抑制効果を示すか検討しました。一般に遺伝子発現における翻訳過程は、大腸菌などの細菌と酵母や植物、動物という高等生物の間ではほとんど違いはありません。したがって、低頻度コドンGFPによる遺伝子発現抑制はヒトの細胞でも有効であると考えました。そこで、ヒトを対象とした低頻度コドンGFP遺伝子(hu-lgfp)を作製し、がん細胞やウイルスの増殖が抑制できるか、検討しました。
まず、ヒト細胞について、HeLa細胞(ヒト子宮頸癌細胞)を用いてその影響を観察したところ、24時間で増殖抑制効果が認められ、48時間後でも細胞の増殖抑制効果が観察できました(図6)。さらにMCF7(ヒト乳がん細胞)とHEK293(ヒト胎児腎細胞)の各細胞においても、hu-lgfp遺伝子は増殖抑制効果を示し、各細胞で対照の約20%以下の増殖率でした(図7)。本hu-lgfp遺伝子の発現が細胞の種類に関わらず、増殖抑制効果を示すことが分かりました。また、大腸菌の生育抑制効果は約4時間でしたが、各ヒト細胞では48時間と非常に長い時間、生育抑制効果が持続しました。
この結果を踏まえ、大腸菌の場合と同様、hu-lgfpの発現がヒト細胞に感染するウイルスの増殖を抑制できるか、実験を行いました。本実験ではヒト細胞に感染するウイルスとして、実験用に改変されたアデノウイルス(改変アデノウイルス)をモデルとして選択しました。アデノウイルスは一般に風邪のウイルスとして知られていますが、改変アデノウイルスはこれを毒性を持たずにHEK293細胞のみで増殖可能にしたものです。HEK293細胞を宿主として、hu-lgfp遺伝子を発現させた後、改変アデノウイルスに感染させる実験を行いました。一方で、細胞やウイルスの増殖に影響しないルシフェラーゼという発光酵素をhu-lgfp遺伝子の代わりに用いた対照実験も行いました。
それぞれの遺伝子を発現させたHEK293細胞に改変アデノウイルスを感染させ、72時間培養を行い、細胞の生存数とウイルスの数を測定しました。その結果、ルシフェラーゼを発現するHEK293株では約80%の細胞が死滅し、ウイルスも約65倍に増殖していました。これは、改変アデノウイルスがルシフェラーゼを駆逐してしまったことを意味します。
一方、hu-lgfp遺伝子を発現するHEK293株では、細胞数が低下するどころか約1.4倍に増殖していました。また、ウイルスも約3.5倍に増殖していましたが、対照と比較すると1/18以下に抑えられていました。この結果から、hu-lgfp遺伝子の発現は改変アデノウイルスの増殖を抑制することがわかりました(図8)。
以上の一連の実験結果から、低頻度コドンGFP遺伝子は、原核生物(細菌類)、真核生物(ヒト細胞など)、ウイルス全てに増殖抑制効果を示すことが明らかとなりました。
4.今後の展望
現在の医薬品は一般的な化学物質が利用されていることから、変異による耐性菌の出現等でその有効性が損なわれることがあります。また、最近注目されている遺伝子治療についても、病気に関する遺伝子の特定や遺伝子の個人差等の問題があり、なかなか医薬品のような「一般化」が難しいと言われています。
本研究で用いた低頻度コドン遺伝子は、特に抗菌活性、細胞毒性や抗ウイルス活性を持つタンパク質ではなく、一般的に用いられるGFPを発現します。また、特定のタンパク質や塩基配列を標的にせず、コドン使用頻度に依存しています。コドン使用頻度は、全ゲノム遺伝子配列により決定されているため、容易に改変できません。
ウイルスや癌細胞、病原菌等は変異により各種薬剤耐性を獲得することができますが、本低頻度コドン遺伝子の影響に耐性を得るためには、全ゲノム遺伝子の改変が必要であり、事実上不可能と考えられます。例えば、生物本来のタンパク質をモチーフとして、低頻度コドン遺伝子を構築し、ウイルスや病原菌が感染すると発現する遺伝子ネットワークを構築できれば、安全で非特異的な防御機構を構築できると予想されます。
このため、本システムは、積極的に細菌やウイルス、癌細胞を死滅させることはできませんが、非特異的な増殖抑制効果や生理活性物質を生産しないという安全性から、将来的な遺伝子治療へと応用されることが期待されます。
一方で、本研究は細胞レベルでの基礎研究段階であり、実用にはまだ多くの実験を重ねる必要があります。今後の課題としては、低頻度コドン遺伝子が実際に病原性ウイルスへも耐性を与えるのか、実際の癌組織に抗がん活性を示すのか、またこの人工遺伝子が生体レベルでも問題なく機能するのか等を確認する必要があり、このためには、医療研究機関等との連携によりさらなる検証に取り組み学分野への応用について研究を進めていきたいと考えています。
本研究成果は特許取得済みです。
特許第5396071号「細胞の増殖を抑制する方法」
特許権者:海洋研究開発機構
※1 低頻度コドン:使用頻度の低いコドンのこと。コドンとは、遺伝子情報を担うメッセンジャーRNA(mRNA)を構成する4種類(アデニン(A)、ウラシル(U)、グアニン(G)、シトシン(C))の塩基のうち、連続する3つの組み合わせから成る塩基配列を指す。コドンにアミノ酸が連結されることでタンパク質が合成されていくが、このとき各コドンに対応するアミノ酸の種類は決まっている。組み合わせ上、複数のコドンが同じアミノ酸に対応し、どのコドンが使われるか(コドン使用頻度)は生物によって異なり、偏りがある。
※2 緑色蛍光タンパク質(GFP):緑色の蛍光を出すタンパク質のこと。分子生物学では、遺伝子発現の目安として良く用いられる。
※3 脆弱性:システム上の欠陥の事。主にコンピューターシステムやプログラムで指摘され、コンピューターウイルスやハッカーなどに狙われる弱点のこと。
※4 DoS攻撃:Denial of Service (DoS)攻撃は、サーバーなどコンピューターネットワーク構成機器に対して、処理できない多大な情報を送信するなど、サービスを停止させることである。本研究の場合、数が少ない低頻度コドン対応tRNAに対して、人工合成遺伝子が大量の要求を行うことで、細胞のために使用される低頻度コドン対応tRNAを消費して、通常のタンパク質生産を停止されることを指します。
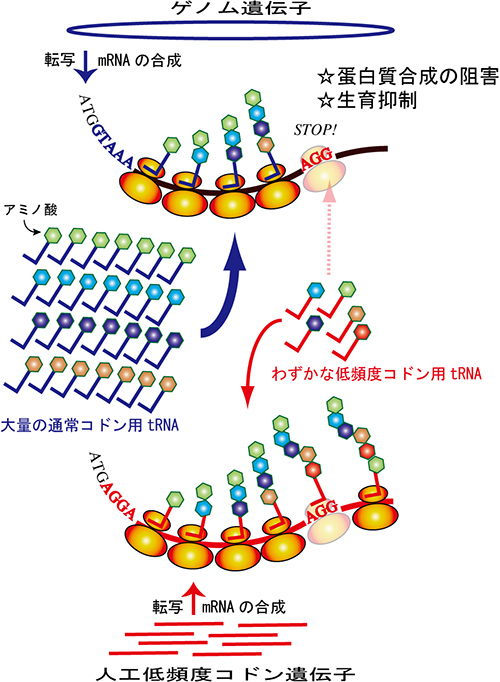
図1 低頻度コドンgfp遺伝子の発現による蛋白質発現の阻害モデル
低頻度コドンで構成されたgfp遺伝子が低頻度コドンに対応するtRNAを独占する事で、細胞の蛋白質の合成を阻害し、細菌やウイルス、細胞の増殖を抑制する。
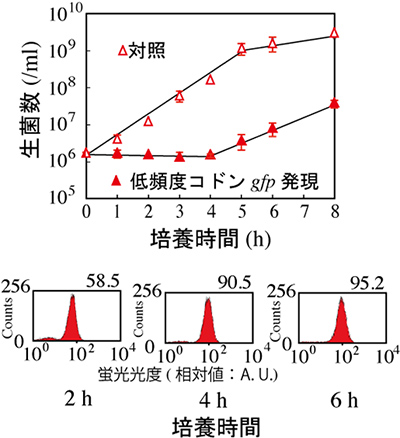
図2 低頻度コドンgfp遺伝子発現による大腸菌の増殖抑制
低頻度コドンgfp遺伝子の発現を行うと、大腸菌の生育が4時間程度抑制される(上図)。一方、GFPの発現は認められ、蛍光が観察できた(下図)。
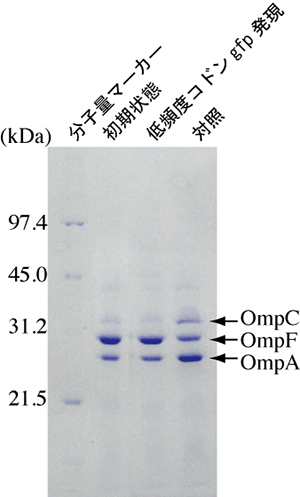
図3 大腸菌の塩濃度変化適応に対する低頻度コドンgfp遺伝子の影響
低塩濃度環境ではOmpFが発現する(初期状態)。高塩濃度環境へ移行するとOmpCが発現し始める(対照)。低頻度コドンgfp遺伝子が発現していると、OmpCの発現は見られない。
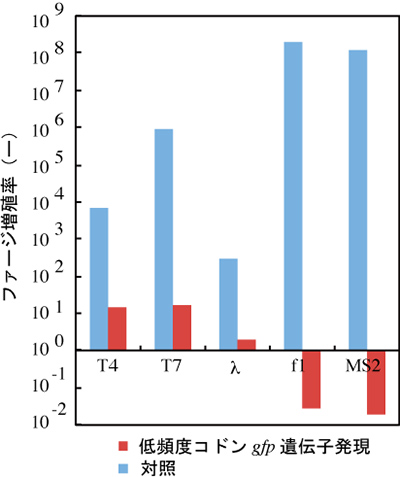
図4 低頻度コドンgfp遺伝子発現によるファージ増殖の抑制
宿主は大腸菌を用いて、大腸菌に感染するウイルス(ファージ)を添加し、その増殖率を測定した。T4, T7, λ,f1, MS2の全てのファージに対して、対照と比較して増殖抑制効果が認められた。
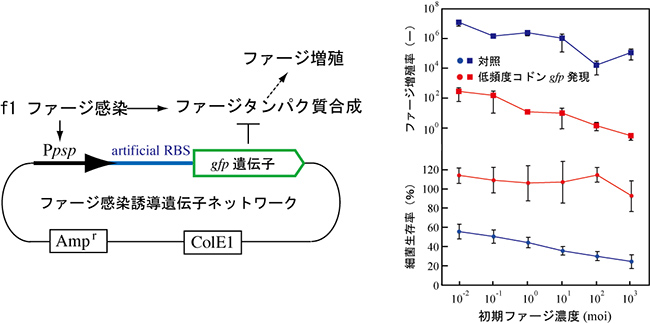
図5 ファージ感染発現誘導遺伝子ネットワークによるファージ耐性の獲得
低頻
度コドンgfp遺伝子をpspプロモーターの下流に配置し、ファージ感染により、低頻度コドンgfp遺伝子が発現する人工遺伝子ネットワークを構築した(左図)。本人工遺伝子ネットワークを持つ大腸菌はf1ファージ感染に対して耐性を持った(右図)。
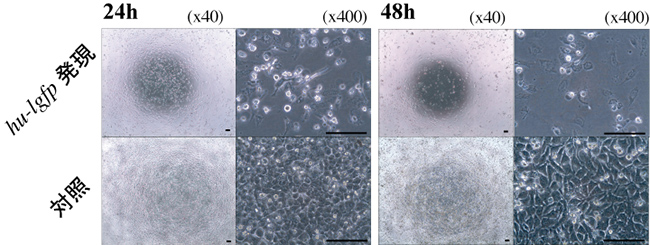
図6 ヒト用低頻度コドンgfp遺伝子(hu-lgfp遺伝子)発現によるHeLa細胞の増殖抑制効果
ヒト子宮頸癌細胞(HeLa細胞)にてhu-lgfp遺伝子の一過性発現を誘導した。そのまま培養を行い、24時間と48時間後の殖した細胞を観察した。hu-lgfp遺伝子発現により、Hela細胞の増殖が抑制されていることがわかる。バーは100 μmを示す。
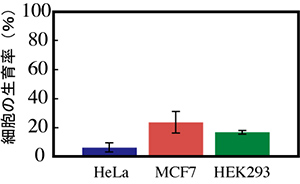
図7 hu-lgfp遺伝子発現によるヒト細胞への増殖抑制効果
各細胞にて、hu-lgfp遺伝子の一過性発現を誘導した。48時間培養し、対照と比較した。3株全てで、増殖抑制効果が認められた。
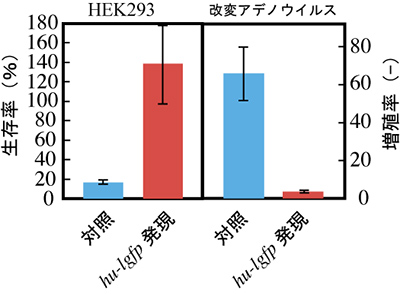
図8 hu-lgfp遺伝子発現による改変アデノウイルスの増殖抑制効果
HEK293細胞を宿主として、hu-lgfp遺伝子発現下にて改変アデノウイルスの感染実験を行った。72時間後の結果、対照と比較して発現誘導を行っている細胞の増殖が認められ、アデノウイルスの増殖も抑えられた。